上一篇溶離文章「藥物溶離試驗的成功要素」中提到,溶離系統必須定期進行MQ (Mechanical Qualification,又稱為物性校驗),以確保溶離系統能產出良好且穩定的試驗數據,可見MQ要求檢查的項目絕對會影響溶離試驗結果,但影響程度有多大呢?這就是今天我要分享給各位的。除此之外,還有一些同樣會影響到溶離結果,但並非MQ測項的變動因素,我也會一併說明,當你需要開發溶離方法時,這些資訊也許能幫上你的忙。讓我們先從MQ的檢查項目開始說起。
1. 晃動(wobble)
USP<711>對於轉軸(shaft)的描述是「不得有明顯的晃動」,並未定義晃動標準,但有另一段話提到:「轉軸的旋轉軸線與溶離杯垂直軸線,其偏差不得超過2.0mm。」儘管這段話並不是對晃動的明確規範,仍可藉此將±2mm作為晃動的標準。現在市面上有可用來量測晃動度的工具(亦可用於測量中心點偏移),量測值以TIR (total indicator reading,又稱量表讀數差)來表達,當晃動標準為±2mm時,代表用工具量出來的TIR必須小於4mm。若參考USP於2010年推出的USP Dissolution Toolkit 2.0,晃動標準為TIR = 2mm,這與ASTM E2503 – 13(2020)的要求一致。
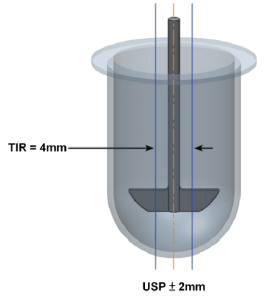
圖1:晃動度的量化計算方式
至於晃動對溶離率的影響有多大呢?學者研究微彎的轉籃桿(basket shaft)與槳桿(paddle shaft),觀察晃動對USP水楊酸及Prednisone標準片的影響1,2,結果顯示:
A. 籃法:與TIR = 2.0mm相比,TIR為2.0~5.0mm時,標準片的溶離率增加約5%。
B. 槳法:與TIR < 0.5mm相比,TIR為1.0~2.0mm時,水楊酸與Prednisone標準片的溶離率分別增加8%與4%。
由此可知,晃動對槳法的影響更顯著,所以槳法的晃動TIR標準應低於1.0mm (甚至0.5mm),才足以減少晃動的影響。
2. 中心點(centering)
USP<711>提到:「轉軸的旋轉軸線與溶離杯垂直軸線,其偏差不得超過2.0mm。」此標準亦能作為中心點的標準,也就是TIR = 4mm,而ASTM E2503 – 13(2020)的標準則為TIR = 2mm。中心點偏移對溶離結果的影響有多大?研究顯示,當轉軸偏離溶離杯中心軸線2~6mm時,溶離速率會顯著增加2%~10%1,2。

圖2:中心點量測工具
如何避免中心點偏移?除了耐用的溶離系統與尺寸精準的溶離杯外,溶離杯固定在溶離平台上的方式也是關鍵。傳統的固定方式是利用平台上的彈簧卡扣來卡住溶離杯口,但彈簧用久了會彈性疲乏,影響固定能力而讓中心點的偏移,所以現在已經有新的固定方式:「固定環旋轉卡扣」,不須使用彈簧就可以將溶離杯固定在平台上,而且固定環與溶離杯口結合為一體,可避免安裝或取下溶離杯時,不小心撞裂溶離杯口,保護溶離杯口不破損。

圖3:新式溶離杯固定方式
3. 轉速(drive speed)
根據USP<711>的規範,轉速變化不得超過±4%,ASTM E2503 – 13(2020)則為±2rpm或±2%。轉速對溶離試驗的影響大嗎?對大多數的試驗來說,轉速的變化對溶離率的影響幾乎是線性的。當轉軸開始轉動時,溶離液開始流動,這會改變溶離液與製劑之間液體-固體的介面性質,根據研究,而液體-固體介面的性質可能是整個溶離過程的關鍵2,3,所以選擇一個平穩且可靠的溶離系統十分重要,轉速的誤差範圍應該要越小越好,現今的技術已經可以把轉速精確控制到0.1rpm了。

圖4:以轉速計測量轉速
4. 溫度(temperature)
一般來說,溶離率與溫度呈線性關係,每1°C度的溫度變化,會引起高達5%的溶離率變化2。根據USP<711>與ASTM E2503規範,溫度可容許的變動範圍為±0.5°C,但對於某些製劑來說,這樣的溫度變化會引起過大的溶離率變動,所以溫度因素應該當作溶離方法的耐變性(robustness)來做確認。
進行溶離試驗時,應選擇適合的時間間隔來記錄溫度,或至少應該在試驗前後進行溫度檢查,這點對於自動溶離系統來說十分容易,因此可將溫度檢測視為常態的檢查步驟。
順便一提,若你的試驗會用到塑膠製溶離杯,由於塑膠的導熱能力只有玻璃的30%,你必須提高水浴槽的設定溫度(例如提高到38~39°C),才能讓溶離杯內的溫度維持在37°C。此外,別忘記裝上杯蓋,因為熱量會不斷從溶離液表面散失,不裝杯蓋會讓塑膠製溶離杯更難達到溫度平衡。
5. 杯底距離
根據USP<711>與ASTM E2503 – 13(2020)規範,轉籃或槳到杯底的距離為25±2mm。這是一個十分明確的指引,意指裝置(籃或槳)於溶離杯中都應處於相同的位置。
研究人員曾研究過杯底距離對溶離結果的影響,用12槽溶離機來執行Prednisone標準校正片的試驗,但將前六槽的杯底距離調到25mm,後六槽槽則調整為24mm4,比較試驗結果後發現,前六槽與後六槽溶離率的幾何平均數(GM)有著3%的差距,因此在進行溶離方法開發時,應謹慎評估杯底距離的影響。

圖5:使用杯底距離測量工具
6. 垂直度(shaft verticality)
無論是籃法或是槳法,為了得到可以重現的溶離結果,轉軸垂直度理想上應為90°,轉軸若過度傾斜,必然嚴重影響溶離結果,但USP<711>沒有垂直度的規範,USP Dissolution Toolkit 2.0提到垂直度的偏差應在0.5°內,ASTM E2503 – 13(2020)則規定偏差必須在1°內。
根據已發表的研究顯示2,當轉軸的傾斜度超過2°時,槳法的溶離率會增加2%~25%。以Prednisone標準片進行槳法溶離試驗時,若強制將轉軸傾斜約7°,溶離率會增加至30%之多5,若發現轉軸傾斜,請務必聯絡儀器廠商前來處理。

圖6:轉軸垂直度量測與槳桿安裝
7. 震動(vibration)
根據USP<711>的內容,系統不得有顯著影響溶離率結果的震動,這種描述又給試驗人員帶來了難題,到底何種程度的震動是可以忍受的呢?PhRMA(美國藥品與製造協會)的一篇文章中3,給出了震動限度值為 ≤ 0.2 mil。
為何震動會影響溶離結果?震動就意味著能量的傳遞,系統中的震動會將能量疊加到溶離液中的流體動能,造成溶離率提升,因此會對溶離結果帶來重大影響。
1971年,研究人員發現當溶離杯的震動位移從0.05mil 增加到0.8mil時,Tolbutamide藥錠的溶離率增加6倍6。1975年,Bill Hanson博士發表了一篇震動對USP水楊酸校正片影響的文章,證明震動是溶離試驗誤差的主要來源7。Bill Hanson博士觀察到,當震動0.1mil時,溶離率會增加5%~10%,因此建議將震動降低到0.1mil以下。
說實在話,震動來源無所不在,除了選擇精心設計的溶離系統外,降低外部環境所引起的震動同樣重要。實驗室有許多裝置會製造震動,像是抽風櫃、離心機、空調、風扇、超音波震盪機、恆溫震盪槽與幫浦等設備,還有一些常被忽略的震動來源,如建築物內的施工、實驗室人員的腳步輕重、開關儀器放置平台底下的置物抽屜、甚至是開關實驗室的門,由於這些震動來源是間歇性的,因此更容易被忽略,不可不慎。
8. 溶離液除氣(media deaeration)
USP<711>中雖有提到除氣手法,但並未提供明確標準。根據相關研究指出8,以USP<711>的做法除氣後,溶離液的含氧量會介於4~7 mg/L。對某些藥物來說,溶離液是否除氣會大大影響到溶離率2,以Prednisone標準片為例,若不除氣,溶離率的相對標準偏差(CV)會增加12%之多,因此研究人員在開發溶離方法時,應仔細評估氣體對試驗結果造成的影響。
現在市面上有已經商品化的自動溶離液除氣裝置,除了能在20分鐘內完成溶離液除氣,還能自行設定注入溶離杯中的溶離液體積,不再需要用到量筒或定量瓶來量取溶離液,更進一步提升試驗效率與穩定性。
9. pH值
隨著藥物在溶離液中不斷地溶解,可能會改變溶離液的pH值,若pH值會影響到該藥物的溶離曲線,便會得到錯誤的溶離結果,改用緩衝溶液來做溶離試驗便能解決pH值改變的問題,但這是否表示水不適合做為溶離液?學者們有著不同的看法9, 10,有些學者認為水不是緩衝溶液,而且沒辦法代表人體內的腸胃環境,所以用水做出來的溶離結果不具代表性,但也有學者認為水可以得到有用的溶離結果。無論如何,在開發溶離方法時,應檢查pH值是否在溶離試驗結束後發生改變。此外,pH值的變化也可能影響到UV吸收值,所以分析人員應針對不同pH值的溶離液來配置標準樣品與空白樣品。
10. 體積(Volume)
一般來說,溶離液體積在整個溶離試驗中應保持恆定,所以每次取樣後,應回補空白溶離液(此步驟被稱為media replace),以維持總體積的恆定。也有許多人選擇不進行回補,而是利用計算的方式,藉由校正因子(correction factor)來校正取樣造成的濃度變化,但這個做法的前提是校正因子必須小於25%11。
此外,你也不可以忽略蒸發所造成的體積損失。若環境濕度偏低,蒸發的損失量可能會超過15mL11。溶離液的蒸發損失可分為兩個部份:試驗前等待溶離液溫度穩定時的蒸發,以及試驗中溶離液的蒸發。除了使用良好設計的溶離杯蓋來減少蒸發量,也可以利用市售的自動溶離液除氣裝置直接輸出37°C的溶離液到溶離杯中,縮短等待溶離液溫度穩定的時間,進而降低溶離液蒸發量。
11. 流體力學影響
根據Cox等人在USFDA的研究12,取樣針與溫度探針不應一直插在溶離液中,以免影響溶離液的流體性質。Savage與Wells13的研究發現,取樣針直徑為7mm時,一直插在溶離杯內會造成溶離率顯著改變,但直徑為1.5mm時則只有很小的變化,在自動取樣系統越來越普及的現在,更不能忽視取樣針或溫度探針造成的影響,若取樣針或溫度探針直徑大於1.5mm,除非正要取樣,否則取樣針或溫度探針應維持在溶離杯外。
12. 吸附
特定材料(例如塑膠)可能會吸附藥物中的活性成分,取樣後用來過濾溶離液的濾膜(filter)就很容易遇到吸附問題,請務必要挑選不會吸附活性成分的濾膜,或是用預飽和/預沖洗的方式來處理濾膜:讓足量的樣品通過濾膜,使濾膜的吸附點飽和,之後再收集流過濾膜的樣品來分析,便可得到沒有損失活性成分的樣品。
自動取樣系統中的管線同樣可能會吸附活性成分,所以最安全的做法就是選擇吸附問題最小的材質來製造自動取樣系統,像是聚四氟乙烯(例如FEP)、玻璃與316不鏽鋼等材料。
結論
本文介紹了多種可能影響溶離試驗結果的變動因素,就算溶離系統已經調整到符合MQ要求,試驗結果還是會有一定程度的偏差,主因在於藥典的規範相對寬鬆,在各個變動因素的加乘下,就有可能造成不容忽視的試驗影響,除了購買品質優良的溶離系統外,使用者平時應好好維護系統的硬體狀態,定期執行溶離系統的保養,以維持溶離系統硬體的最佳狀態。

圖8:工程師使用校驗工具驗證溶離機
此外,實驗人員應受過足夠的儀器操作訓練與GMP訓練,若缺乏GMP意識,則可能造成試驗數據上的影響,例如UV比色槽(cuvette)沒有清洗乾淨、設備安裝不當、轉籃(basket)變形、未注意取樣位置等不能被接受的操作方式,都可能影響試驗結果,所以實驗室應該要設計GMP培訓計畫,並進行內部查核,以確保實驗人員遵守GMP規範,才能減少人為誤差並得到更加準確的數據。
最後,您是不是對於溶離試驗的變動因素有更深刻的了解了呢?如想了解更多的校驗與驗證細節,或有MQ(物性校驗)與PVT(性能驗證)服務需求者,歡迎來電 02-2728-2767或 來信與我們聯繫。
最後,您是不是對於溶離試驗的變動因素有更深刻的了解了呢?如想了解更多的校驗與驗證細節,或有MQ(物性校驗)與PVT(性能驗證)服務需求者,歡迎來電02-2728-2767或 來信與我們聯繫。
參考文獻
- W. Hanson, “Solving the Puzzle of Random Variables in Dissolution Testing,” Pharm. Technol. 1, 30–41 (1977)
- Hanson, W, “Studies on the Effects of Some Variables Commonly 98 HANDBOOK OF DISSOLUTION TESTING Encountered in the Measurement of Dissolution Rate of Solids”, 1979, Ph. D. Dissertation, California Western University.
- John Mauger, John Ballard, Robert Brockson, Sinjan De, Vivian Gray, and Dennis Robinson. Intrinsic Dissolution Performance Testing of the USP Dissolution Apparatus 2 (Rotating Paddle) Using Modified Salicylic Acid Calibrator Tablets: Proof of Principle. Dissolution Technologies | AUGUST 2003.
- Johannes Kraemer and Rolf Schwan. Practical Aspects of Dissolution Instrument Qualification—a European Perspective. Dissolution Technologies | MAY 2011.
- Thakker, D, Naik, N, Gray, V and Sun S, “Fine Tuning of Dissolution Apparatus”, 1980, Pharmacopeial Forum, 6 (2), 177-185.
- W. Beyer and D. Smith, “Unexpected Variable in the USP/NF Rotating Basket Dissolution Rate Test,” J. Pharm. Sci. 60, 2350–2351 (1971)
- Hanson, W, “Effect of Vibration on Dissolution Rates”, 1975, Presented at the Becknan Conference an Dissolution, Mountain- side, NI Cartwright
- Thomas Curley, Richard Forsyth1, Susan Sun, Kyle Fliszar,Mitch Colletto and Gregory P. Martin. Measurement of Dissolved Oxygen as a Determination of Media Equilibrium During Dissolution Testing. Dissolution Technologies | NOVEMBER 2004.
- Noory, C, Tran, N, Ouderkirk, L, Brown, S, Perry, J, Lopez, Colon, M, Faberile, M, Henry, K, Rorberg, J, Ali, SN and Shah, V, “Rethinking the Use of Water as a Dissolution Medium”, 1999, Dissolution Technology, 6 (4), 6-7.
- Leeson, LJ, “Some Observations on Rethinking the Use of Water as a Dissolution Medium”, 2000, Dissolution Technology, 7(2), 16 – 17.
- Handbook of Dissolution Testing.
- Cox, D, Douglas, C, Furman, W, Kirchhoefer, R, Myrick, J and Wells, C, “Guidelines for Dissolution Testing”, 1978, Pharmaceutical Technology, 2 (4), 40 – 53.
- Savage, TS and Wells, CE, “Automated Sampling of In Vitro Dissolution Medium: Effect of Sampling Probes on Dissolution Rate of Prednisone Tablets”, 1982, Journal of Pharmaceutical Sciences, 71, 670 – 673.